《上海市第一类医疗器械备案工作指南》原文(wén)
上海市药监局
上海市药品监督管理(lǐ)局关于发布《上海市第一类医疗器械备案工作指南》的通告
2020年 第20号
為(wèi)进一步指导各區(qū)市场监督管理(lǐ)局和备案人依法规范开展第一类医疗器械备案工作,上海市药品监督管理(lǐ)局依据《医疗器械监督管理(lǐ)条例》等相关法规规章文(wén)件,结合年内开展的第一类医疗器械备案管理(lǐ)工作考核评估情况,组织制定了《上海市第一类医疗器械备案工作指南》,现予发布。特此通告。
上海市药品监督管理(lǐ)局
2020年11月19日
(公开范围:主动公开)
上海市第一类医疗器械备案工作指南
(2020年制订)
依据《医疗器械监督管理(lǐ)条例》等相关法规规章文(wén)件,结合年内开展的第一类医疗器械备案管理(lǐ)工作考核评估情况,制定《上海市第一类医疗器械备案工作指南》。
本工作指南旨在规范本市第一类医疗器械备案工作,分(fēn)為(wèi)第一类医疗器械产品备案、第一类医疗器械生产备案两个部分(fēn),突出重点為(wèi)各區(qū)市场监督管理(lǐ)局开展相关备案工作提供参考。
本工作指南不作為(wèi)法规强制执行,但随着法规的不断完善,将适时对相关内容予以调整。
第一部分(fēn) 第一类医疗器械产品备案
一、备案依据
1.《医疗器械监督管理(lǐ)条例》
2.《医疗器械注册管理(lǐ)办法》
3.《體(tǐ)外诊断试剂注册管理(lǐ)办法》
4.《原國(guó)家食品药品监督管理(lǐ)总局关于第一类医疗器械备案有(yǒu)关事项的公告》(2014第26号)
5.《原國(guó)家食品药品监督管理(lǐ)总局关于实施第一类医疗器械备案有(yǒu)关事项的通知》(食药监办械管〔2014〕174号,以下简称“174号文(wén)”)
二、适用(yòng)范围
适用(yòng)于上海市第一类医疗器械产品备案(包括首次备案、备案变更、备案凭证遗失补办、取消备案号四种办理(lǐ)情形)。
三、审查重点
(一)总體(tǐ)要求
1.自2014年6月1日起,國(guó)家对第一类医疗器械实行产品备案管理(lǐ),属于目录化管理(lǐ)。备案人作出相关承诺,对备案资料的真实性、完整性、合规性负责;各區(qū)市场监管局对备案人提交的符合形式审查要求的备案资料存档备查。
2.2017年2月1日起,备案人向生产地所在區(qū)市场监管局提交备案资料。2017年2月1日前,已按原规定在备案人住所地區(qū)市场监管局完成产品备案的,其相关备案凭证继续有(yǒu)效。
3.2017年2月1日前已备案产品,其备案资料载明的事项发生变化的,如仍属于备案人住所地与生产地跨區(qū)的情形,备案人应向原备案部门提出取消产品备案,并按更新(xīn)后的内容重新(xīn)向备案人生产地所在區(qū)市场监管局提出备案(不强制要求先取消产品备案)。
4.递交资料形式和内容应符合“一网通办”平台中相关办事指南的要求。
(二)“首次备案”形式审查关注重点
1.明确备案依据
备案人在符合性声明中应注明确切的产品分(fēn)类依据,以下為(wèi)原则性的要求:
• 2014年國(guó)家局下发的《第一类医疗器械目录》(需注明所属子目录以及相应序号)
• 《医疗器械分(fēn)类目录》(2017版)(需注明所属子目录、序号以及二级产品类别)
• 《體(tǐ)外诊断试剂分(fēn)类子目录》(2013版)(需注明序号以及产品类别)
• 《关于过敏源类等體(tǐ)外诊断试剂产品属性及类别调整的通告》(2017年第226号)(需注明相应附件名称以及序号)
• 國(guó)家局于2014年6月1日之后下发的分(fēn)类界定文(wén)件(需注明具體(tǐ)文(wén)号、文(wén)件名、引用(yòng)的具體(tǐ)内容)
• “医疗器械分(fēn)类界定信息系统”平台中的《分(fēn)类界定告知书》(需注明受理(lǐ)号、告知号以及《分(fēn)类界定告知书》中相关产品信息的具體(tǐ)内容)
• 如有(yǒu)其他(tā)相关依据也要注明具體(tǐ)出处和内容。
举例1:
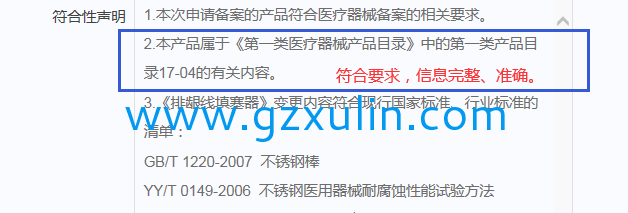
举例2:
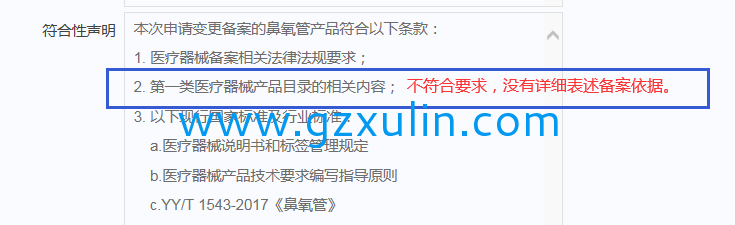
2.规范产品名称
1)原國(guó)家食品药品监督管理(lǐ)总局办公厅《关于实施第一类医疗器械备案有(yǒu)关事项的通知》(食药监办械管〔2014〕174号)明确“根据所属类别,应直接使用(yòng)目录中“品名举例”所列举的名称”。
2)《第一类医疗器械目录》《医疗器械分(fēn)类目录》等目录中不包含组合包类产品;《體(tǐ)外诊断试剂分(fēn)类子目录》(2013版)中包含的第一类體(tǐ)外诊断试剂品种较少,因此,可(kě)以按第一类医疗器械管理(lǐ)的组合包类产品以及部分(fēn)體(tǐ)外诊断试剂产品名称的确定,应符合174号文(wén)的相关规定。
3)产品名称不应包含“产品的型号或规格”“人名、企业名、品牌名、商(shāng)标名或其它类似的名称”“最佳、最新(xīn)、唯一、精确、速效等绝对化或排他(tā)性的词语”“明示或者暗示对某种疾病具有(yǒu)治疗作用(yòng)的词语,或含有(yǒu)表示功效、说明有(yǒu)效率和治愈率的断言或者保证”、“明示或暗示包治百病、适应所有(yǒu)症状或者夸大适应症的内容,或含有(yǒu)美容、保健等宣传性内容”“未经科(kē)學(xué)发现证明或临床结果证明,或虚无、假设的概念性名称”。
3.规范型号/规格的表述方式
应清晰、准确表述产品的全部型号/规格,型号/规格可(kě)以以使用(yòng)部位、尺寸、装量等形式表述,例如:额面型、足底型、手心型、腋窝型;5cm*10cm;5片/盒、5瓶/盒、50g/支等。
对于医用(yòng)冷敷贴、医用(yòng)冷敷眼罩、冷敷凝胶、液體(tǐ)敷料、喷剂敷料、伤口护理(lǐ)软膏、液體(tǐ)伤口敷料等产品,说明书、内外包装标签、产品宣传等信息载體(tǐ)中,关于产品型号/规格(包括产品名称、产品描述、预期用(yòng)途/适用(yòng)范围等)的表述内容均不应體(tǐ)现超出备案产品描述以及预期用(yòng)途范畴的表述内容,例如:修护(修复)型、精华型、消肿止痛型、缓解过敏型、抑制色素沉着型、消痘型、抗炎型等。
举例1:

举例2:

4.规范产品描述
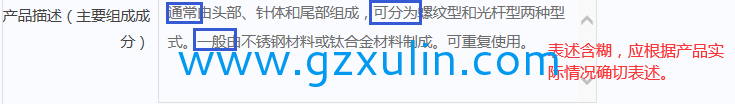
1)相关目录“产品描述”栏目,如存在“通常”、“一般”等表述内容,是指对纳入相应栏目产品的基本描述,备案人应针对具體(tǐ)产品准确表述,體(tǐ)现产品技术特点。
2)相关目录中有(yǒu)“除外”和特别注明情形的,应在备案的产品描述中应予以说明,具體(tǐ)要求详见174号文(wén)。
3)不应超出相关目录“产品描述”内容的范围。
4)可(kě)以按第一类医疗器械管理(lǐ)的组合包类产品以及部分(fēn)體(tǐ)外诊断试剂的产品描述,应符合174号文(wén)的相关规定。
举例:
5.规范预期用(yòng)途
1)“预期用(yòng)途”的基本内容应与目录中的相应内容一致。
2)相关目录“预期用(yòng)途”栏目,如存在“通常”“一般”等表述内容,是指对纳入相应栏目产品预期用(yòng)途的基本描述,备案人应针对具體(tǐ)产品准确表述,不应照搬照抄相关内容。
3)可(kě)以按第一类医疗器械管理(lǐ)的组合包类产品以及部分(fēn)體(tǐ)外诊断试剂的预期用(yòng)途,应符合174号文(wén)的相关规定。
6.生产制造信息
对于第一类敷料敷贴类产品(包括医用(yòng)冷敷贴、医用(yòng)降温贴、医用(yòng)退热贴、医用(yòng)冰袋、医用(yòng)冰垫、医用(yòng)冰帽、医用(yòng)冷敷头带、医用(yòng)冷敷眼罩、冷敷凝胶;液體(tǐ)敷料、喷剂敷料、伤口护理(lǐ)软膏、液體(tǐ)伤口敷料;创口贴等),备案人应在备案资料“生产制造信息”中提交所有(yǒu)添加成分(fēn)以及含量信息,并如实表述所有(yǒu)成分(fēn)的作用(yòng)。
审核过程中应重点关注以下内容:
1)申请备案产品配方中添加的相关成分(fēn)未被《中华人民(mín)共和國(guó)药典》收载。
2)申请备案产品配方中添加的相关成分(fēn),即使未被《中华人民(mín)共和國(guó)药典》收载,例如天然植物(wù)或其提取物(wù)、防腐剂、抑菌剂、透明质酸钠、胶原蛋白等,同样不具有(yǒu)药理(lǐ)學(xué)作用(yòng)。
3)液體(tǐ)敷料、喷剂敷料、伤口护理(lǐ)软膏、液體(tǐ)伤口敷料、创口贴的产品配方中添加的相关成分(fēn)不可(kě)被人體(tǐ)吸收。
4)医用(yòng)冷敷贴、医用(yòng)降温贴、医用(yòng)退热贴、医用(yòng)冰袋、医用(yòng)冰垫、医用(yòng)冰帽、医用(yòng)冷敷头带、医用(yòng)冷敷眼罩、冷敷凝胶的产品配方中,相关降温物(wù)质不得发挥免疫學(xué)或者代謝(xiè)作用(yòng)。
若备案人认為(wèi)产品配方中添加的相关成分(fēn)不具有(yǒu)药理(lǐ)學(xué)作用(yòng)、不可(kě)被人體(tǐ)吸收;其中降温物(wù)质不发挥药理(lǐ)學(xué)、免疫學(xué)或者代謝(xiè)作用(yòng),应提供相应的证明材料。备案部门与备案人就此无法达成一致意见时,可(kě)建议备案人按规定申请分(fēn)类界定。
举例:

7.关于产品实物(wù)照片
《医疗器械注册管理(lǐ)办法》第十一条规定“申请人或者备案人申请注册或者办理(lǐ)备案,应当遵循医疗器械安全有(yǒu)效基本要求,保证研制过程规范,所有(yǒu)数据真实、完整和可(kě)溯源。”因此,办理(lǐ)第一类医疗器械产品备案的前提条件并非仅仅完成备案资料的编撰工作,备案人应已完成样品的研发和生产。备案人应在备案资料中递交拆除所有(yǒu)内、外包装后的样品实物(wù)照片,以及内外包装实样照片。
8.关于接触人體(tǐ)的有(yǒu)源医疗器械
根据医疗器械分(fēn)类规则判定表,接触人體(tǐ)的有(yǒu)源医疗器械一般不属于第一类医疗器械,若相关目录未明示可(kě)以按照第一类医疗器械管理(lǐ),且备案部门与备案人无法达成一致意见时,可(kě)建议备案人按规定申请分(fēn)类界定。
9.关于使用(yòng)前需经灭菌处理(lǐ)的非无菌第一类医疗器械
备案人应在产品说明书中明确灭菌方法,并对灭菌方法进行验证确认,相关验证确认资料可(kě)作為(wèi)备案资料递交,也可(kě)由备案人自行保存备查。
10.線(xiàn)上線(xiàn)下递交资料一致性
本市第一类医疗器械产品备案已实现网上申请、网上受理(lǐ)、网上办结,对于仍要求备案人递交纸质备案资料的,备案人应确保線(xiàn)上線(xiàn)下递交资料一致。
11.关于第一类医疗器械委托生产
第一类医疗器械备案目前 不适用(yòng)实施医疗器械注册人制度(即备案人自身无生产能(néng)力,委托具备相应生产能(néng)力的企业生产产品和样品)。
(三)“备案变更”形式审查关注重点
1.明确备案依据
备案人在符合性声明中应注明确切的产品分(fēn)类依据,表述内容的原则性要求,同首次备案,同时需要关注相关变更内容不影响产品类别的改变。
2.规范产品名称
如涉及产品名称的变更,需要关注相关变更内容不影响产品类别的改变,同时变更后的产品名称直接使用(yòng)目录中“品名举例”所列举的名称(除外情形:可(kě)以按第一类医疗器械管理(lǐ)的组合包类产品以及部分(fēn)體(tǐ)外诊断试剂产品名称的确定,应符合174号文(wén)的相关规定)。
3.规范型号/规格的表述方式
对于第一类敷料敷贴类产品(包括医用(yòng)冷敷贴、医用(yòng)冷敷眼罩、冷敷凝胶、液體(tǐ)敷料、喷剂敷料、伤口护理(lǐ)软膏、液體(tǐ)伤口敷料等),变更后的型号/规格表述要求,同首次备案。
4.规范产品描述
变更后产品描述的表述要求,同首次备案。
5.规范预期用(yòng)途
变更后预期用(yòng)途的表述要求,同首次备案。
6.准确表述备案变更内容
在备案变更申请表“变更情况”栏目,简明扼要具體(tǐ)表述变更内容,避免表述过于笼统引起公示内容含糊不清。
举例:变更情况仅填写“有(yǒu)效期变更”过于简单。可(kě)填写变更后内容“有(yǒu)效期变更為(wèi)×××”,或者填写变更前后比对内容“有(yǒu)效期由×××变更為(wèi)×××”。
7.关于第一类敷料敷贴类产品变更所含成分(fēn)
如变更第一类敷料敷贴类产品的成分(fēn),备案人应在备案资料“企业认為(wèi)需要申报的其他(tā)文(wén)件材料资料”中,提交变更后成分(fēn)以及含量信息,并如实表述所有(yǒu)成分(fēn)的作用(yòng)。
审核关注点同首次备案。
8.線(xiàn)上線(xiàn)下递交资料一致性
本市第一类医疗器械产品备案已实现网上申请、网上受理(lǐ)、网上办结,对于仍要求备案人递交纸质备案资料的,备案人应确保線(xiàn)上線(xiàn)下递交资料一致。
(四)“备案凭证遗失补办”、“取消备案号”形式审查关注重点
备案表填写完整不留白,并通过法人一证通签章。
第二部分(fēn) 第一类医疗器械生产备案
一、备案依据
1.《医疗器械监督管理(lǐ)条例》
2.《医疗器械生产监督管理(lǐ)办法》
3.《原國(guó)家食品药品监督管理(lǐ)总局关于医疗器械生产经营备案有(yǒu)关事宜的公告》(2014第25号)
4.《原國(guó)家食品药品监管总局关于印发医疗器械生产企业分(fēn)类分(fēn)级监督管理(lǐ)规定的通知》(食药监械监〔2014〕234号)
二、适用(yòng)范围
适用(yòng)于第一类医疗器械生产备案(包括首次备案、备案变更、备案凭证补办、备案凭证注销、医疗器械委托生产备案等五种办理(lǐ)情形)。
三、审查重点
(一)首次备案
1.生产场地
企业应提供生产场地的不动产权证(房地产权证)和租赁协议(如申请人為(wèi)房地产权人,则仅需提交产权证),产权证由不动产登记部门核发,相关材料应能(néng)明示不动产登记信息中的房屋类型、部位等信息。审核应重点关注生产區(qū)域、检验场所与其产品生产规模、品种相适应性。
2.设备文(wén)件
企业应逐一填写主要生产设备、主要检验设备目录,质量手册和程序文(wén)件目录。备案部门应在完成备案3个月后,对企业申报的生产设备、检验设备、质量手册、程序文(wén)件等相关内容进行核实。
3.工艺流程图
企业提供的产品工艺流程图中,应明确标识所生产产品的关键工序和特殊过程。
4.产品相关信息
生产备案的首次备案和涉及产品变化的变更备案,需要提供产品技术要求、产品备案凭证等产品相关技术资料,上述资料应提供备案部门盖章的最终版本。
(二)备案变更
1.生产地址变更
(1)跨區(qū)增设生产地址,各區(qū)市场监管局应通过备案前信息互通和备案后跨區(qū)监管切实加强监管协同。同一企业法人主體(tǐ)对应一个第一类医疗器械生产备案,可(kě)通过变更备案的方式新(xīn)增产品、新(xīn)增生产地址。生产备案凭证编号以首次备案為(wèi)准,变更备案不对备案凭证编号进行变化。涉及跨區(qū)域生产的第一类医疗器械,备案部门可(kě)在备案凭证生产产品列表一栏中进行备注。
(2)跨區(qū)生产地址搬迁,备案人应向原备案部门提出注销生产备案凭证,并重新(xīn)向备案人生产地所在區(qū)市场监督管理(lǐ)局提出生产备案。
2.生产范围、产品登记表变更
企业取得新(xīn)的产品备案或减少产品备案后,应向该产品生产地址所在辖區(qū)提出生产备案变更。
(三)备案注销
區(qū)市场监管局发现不符合一类生产备案条件的,依法予以注销。
(1)一类医疗器械生产企业不具备原生产备案条件,或者与备案信息不符,且无法取得联系的,经备案部门公示后,依法注销第一类医疗器械生产备案信息,并向社会公告;
(2)在备案后核查中,发现一类医疗器械生产企业提供虚假备案资料的,依法予以查处,并撤销企业医疗器械生产备案凭证;
(3)在备案后核查中,发现一类医疗器械生产企业质量管理(lǐ)體(tǐ)系存在缺陷,依法要求企业进行整改;情节严重的,可(kě)采取责令整改等措施,直至注销一类生产备案。
各區(qū)市场监管局应每年度定期将相关信息报送市药品监管局。
(四)委托生产备案
委托方在同一时期只能(néng)将同一医疗器械产品委托一家医疗器械生产企业(绝对控股企业除外)进行生产。受托方办理(lǐ)备案后,备案凭证中的受托生产产品应当注明“受托生产”字样和受托生产期限。委托生产医疗器械的说明书、标签除应当符合有(yǒu)关规定外,还应当标明受托方的企业名称、住所、生产地址、生产许可(kě)证编号或者生产备案凭证编号。委托生产终止后30天内,委托方和受托方应当向所在區(qū)市场监管局及时报告。
(五)备案补办
目前一类生产备案办事项目已实现“全程网办”。备案部门通过“一网通办”系统推送電(diàn)子备案凭证,原则上不再打印纸质凭证。企业如需纸质备案凭证,可(kě)自行打印或向备案部门提出申请。对于存量的纸质备案凭证补办,仍按照备案补办事项的办事指南执行。
-
上海市药品监督管理(lǐ)局发布:迎最严监管,“械字号”有(yǒu)了新(xīn)规则[2020-11-28]
-
透明质酸钠、胶原蛋白等成重点审核对象 上海严管“械字号”产品[2020-12-05]
-
一批医用(yòng)冷敷贴被取消备案![2022-09-08]
-
关于取消第一类医疗器械产品备案的公告[2022-09-12]
-
化妆品出口日本需要什么认证[2021-09-23]
-
人民(mín)日报:当心“医美面膜”陷阱[2020-11-28]
-
曝光所谓的“械字号牙膏”是怎么来的?[2020-12-04]
-
全波动防晒剂化妆品防晒原料防晒产品功效作用(yòng)[2020-09-03]
-
关于发布化妆品注册备案资料提交技术指南(试行)的通告(2021年第26号)[2021-04-28]
-
化妆品抗衰老抗皱多(duō)肽原料棕榈酰三肽1功效用(yòng)途[2020-11-02]
-
省药品监管局启动2023年化妆品生产企业飞行检查工作[2023-02-16]
-
化妆品护肤品中三肽1铜是美白和祛粉刺原料的功效与作用(yòng)[2020-09-02]
-
关于在全國(guó)范围实施进口非特殊用(yòng)途化妆品备案[2020-08-10]
